Preparação da Certificação de Software como Dispositivo Médico: Uma Análise Regulamentar Europeia e Estudo de Caso na Plataforma Clynx®
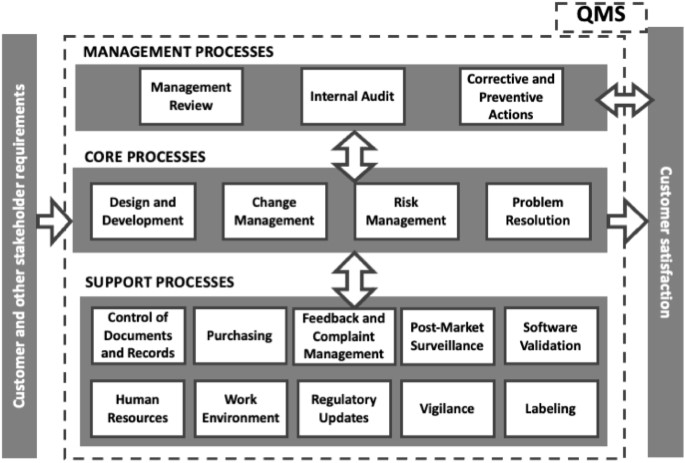
Este estudo explora o caminho para a certificação de software como dispositivo médico de Classe IIa, de acordo com o Regulamento de Dispositivos Médicos 2017/745 (MDR). A metodologia centrou-se no processo de obtenção da marcação Conformité Européenne (CE), com ênfase na compilação de Documentação Técnica, nas nuances da Avaliação Clínica, e no estabelecimento de um Sistema de Gestão da Qualidade. É também descrita uma aplicação a um estudo de caso da indústria. O processo de certificação é conduzido em colaboração com Organismos Notificados, garantindo o cumprimento dos rigorosos requisitos estabelecidos pelo quadro regulamentar existente. Ver mais.